Wakati wa janga la Covid, serikali ya Amerika ilitumia mabilioni ya dola kwa karibu bidhaa 400 zilizokusudiwa kulinda, kugundua, na kutibu mamia ya mamilioni ya watu - zote zikiwa na lebo "EUA" au "Idhini ya Matumizi ya Dharura."
Lakini EUA inamaanisha nini?
Hata kabla ya sisi kujibu swali hilo, na kwa njia ya kuelewa ambapo EUA inasimama kuhusiana na njia nyingine za kuidhinisha au kuidhinisha bidhaa za matibabu, ni muhimu kuangalia nini EUA sio:
EUA Sio Wajibu kwa Bidhaa ya Majaribio Inayofanyiwa Majaribio ya Kliniki
Iwapo tunaelewa jambo moja tu kuhusu EUA inapaswa kuwa hivi: EUA haitumiki kwa bidhaa inayofanyiwa majaribio ya kimatibabu inayosimamiwa na kanuni za FDA au mahitaji mengine ya kisheria.
EUA pia si sawa na Utumiaji Uliopanuliwa wa Ufikiaji (EAU), ambao mara nyingi huitwa ufikiaji wa "matumizi ya huruma", ambayo inatumika kwa kuwapa wagonjwa walio na magonjwa hatari na yasiyotibika ufikiaji wa bidhaa za majaribio kabla ya kuidhinishwa kikamilifu.
Jedwali hili kutoka kwa Uwasilishaji wa FDA-CDC 2020 inatoa muhtasari wa tofauti kati ya bidhaa zinazofanyiwa majaribio ya kimatibabu, bidhaa zinazotolewa kwa wagonjwa kupitia ufikiaji uliopanuliwa wa "huruma", na bidhaa zilizoidhinishwa kupitia EUA:
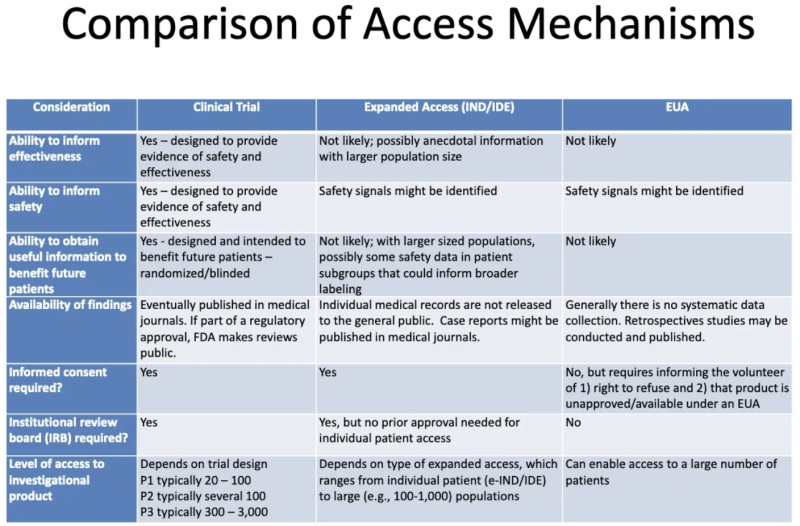
Hivi ndivyo jedwali hili linatuambia kuhusu EUA:
- Mchakato wa kutoa EUA hauwezekani kutoa taarifa yoyote kuhusu ufanisi wa bidhaa.
- Mchakato wa kutoa EUA haujaundwa ili kutoa ushahidi wa usalama au ufanisi, lakini ishara za usalama zinaweza kutambuliwa.
- Haiwezekani, mara tu bidhaa itakapotolewa EUA na kusimamiwa kwa baadhi ya wagonjwa, kwamba taarifa yoyote muhimu itapatikana ili kuwanufaisha wagonjwa wowote wa siku zijazo.
- Hakuna mkusanyiko wa data uliopangwa kuhusu ufanisi au usalama na EUA, na hakuna data inayochapishwa katika majarida ya matibabu kama sehemu ya mchakato wa uidhinishaji wa udhibiti.
- Hakuna kibali cha ufahamu kinachohitajika, lakini wagonjwa "wanaojitolea" kuchukua bidhaa lazima waambiwe wanaweza kukataa na kwamba bidhaa hiyo haijaidhinishwa/inapatikana chini ya EUA.
- Hakuna bodi ya ukaguzi ya kitaasisi (IRB) inahitajika. [IRB ni bodi ambayo inapaswa kulinda ustawi wa masomo ya binadamu katika majaribio ya kimatibabu]
Ili kufafanua zaidi jinsi EUA ilivyo tofauti na mchakato wowote wa uidhinishaji wa kawaida, katika a Taasisi ya Tiba ya 2009 ya uchapishaji wa Chuo cha Kitaifa, tunapata taarifa hii:
Ni muhimu kutambua kwamba EUA si sehemu ya njia ya maendeleo; ni huluki tofauti kabisa ambayo hutumiwa tu wakati wa hali ya dharura na si sehemu ya mchakato wa kuidhinisha dawa. (uk. 28)
Kwa muhtasari:
Mchakato wa kutoa bidhaa EUA hauwezekani kutoa ushahidi wowote wa usalama au ufanisi. Pindi tu bidhaa inapotolewa EUA na kusimamiwa kwa wagonjwa, hakuna uwezekano kwamba taarifa yoyote muhimu itapatikana ili kuwanufaisha wagonjwa wa siku zijazo, kwa sababu hakuna ukusanyaji wa data uliopangwa kuhusu ufanisi au usalama.
Kulingana na maelezo haya yote ya wazi kabisa kutoka kwa CDC/FDA na IMNA, itakuwa sawa kuhitimisha kwamba Uidhinishaji wa Matumizi ya Dharura ni mchakato ambao unapaswa kutumika kwa busara sana na katika hali za dharura tu.
Sasa hebu tuangalie ni aina gani za hali za dharura EUA imeundwa kisheria kushughulikia.
EAU Inakusudiwa kwa Dharura za WMD
Sheria zinazoruhusu "Mbinu ya Ufikiaji" ya EUA iliyofafanuliwa hapo juu ziliundwa kwa ajili ya kesi za dharura kali, za haraka zinazohusisha silaha za maangamizi makubwa (WMD), pia hujulikana kama mawakala wa CBRN (kemikali, kibaolojia, radiolojia, nyuklia).
Hivi ndivyo Utawala wa Chakula na Dawa (FDA) inaelezea mamlaka yake ya EUA:
Kifungu cha 564 cha Sheria ya FD&C (21 USC 360bbb–3) inaruhusu FDA kuimarisha ulinzi wa afya ya umma dhidi ya mawakala wa kibayolojia, kemikali, nyuklia na radiolojia.
Kwa mamlaka hii ya EUA, FDA inaweza kusaidia kuhakikisha kwamba hatua za kimatibabu zinaweza kutumika katika hali za dharura kutambua, kutibu, au kuzuia magonjwa au magonjwa hatari au yanayotishia maisha yanayosababishwa na kibaolojia, kemikali, nyuklia au ajenti za radiolojia wakati hakuna vya kutosha, vilivyoidhinishwa. , na njia mbadala zinazopatikana (kati ya vigezo vingine).
Mamlaka haya ya EUA yalitolewa mwaka wa 2004 chini ya hali maalum zinazohusiana na kujiandaa kwa mashambulizi na maajenti wa CBRN.
Kama nilivyoelezea katika Mswada wa Afya wa Sheria ya Harvard,
Hatimaye, ilikuwa Vita dhidi ya Ugaidi ambayo ingetoa idhini ya matumizi ya dharura. Baada ya matukio ya Septemba 11, 2001 na mashambulizi ya barua ya kimeta yaliyofuata, Bunge lilipitisha Sheria ya Mradi wa Bioshield ya 2004.
The rekodi inaonyesha kuwa Congress ililenga tishio la ugaidi wa viumbe hai, sio kujiandaa kwa janga la kawaida.
Kwa kuzingatia aina finyu kama hiyo ya hali mbaya ya dharura inayohusisha mashambulizi ya WMD, inaeleweka kwa nini "utaratibu wa ufikiaji" wa EUA hauhitaji uangalizi mwingi wa udhibiti au ufuasi wa viwango vyovyote vya utengenezaji au majaribio ya kimatibabu.
Kwa hivyo utaratibu wa ufikiaji wa EUA unahitaji nini?
Hatua 3 za Uidhinishaji wa Matumizi ya Dharura (EUA)
Mambo matatu yanapaswa kutokea ili EUA itolewe kwa bidhaa ya matibabu:
- Katibu wa Usalama wa Taifa, Waziri wa Ulinzi, au Katibu wa Afya na Huduma za Binadamu anahitaji kubaini kuwa kuna dharura inayohusisha shambulio au tishio la shambulio la wakala wa CBRN au ugonjwa unaosababishwa na wakala kama huyo.
- FDA inahitaji kuhakikisha kuwa inatimiza "vigezo vinne vya kisheria" inapotoa EUA.
- FDA inapaswa "kuweka masharti fulani yanayohitajika" katika EUA.
EUA Hatua ya 1: Kutangaza Dharura ya CBRN
Tamko la dharura la EUA ni tofauti na halihusiani na matamko mengine yoyote ya dharura ambayo yanaweza kutolewa na Rais, Katibu wa HHS, au mtu mwingine yeyote. Ni lazima itolewe mahususi kwa madhumuni ya kuwezesha EUA na inaweza kumalizwa au kuongezwa bila kutegemea tamko lingine lolote la dharura.
Hapa ni nini sheria ya EUA inasema ni hali nne zinazowezekana za kuwezesha "utaratibu wa ufikiaji wa EUA:"
- uamuzi wa Katibu wa Usalama wa Taifa kwamba kuna dharura ya nyumbani, au uwezekano mkubwa wa dharura ya nyumbani, inayohusisha hatari kubwa ya kushambuliwa na kibaolojia, kemikali, radiolojia, au wakala wa nyuklia;
- uamuzi wa Waziri wa Ulinzi kwamba kuna dharura ya kijeshi, au uwezekano mkubwa wa dharura ya kijeshi, inayohusisha hatari kubwa ya Umoja Nchi vikosi vya kijeshi, pamoja na wafanyikazi wanaofanya kazi chini ya mamlaka ya Kichwa cha 10 au Kichwa cha 50, cha shambulio na-
- wakala wa kibayolojia, kemikali, radiolojia, au nyuklia; au
- wakala au mawakala ambao wanaweza kusababisha, au kuhusishwa vinginevyo na, hatari ya kutishia maisha na hatari maalum kwa United. Nchi vikosi vya kijeshi;
- uamuzi wa Katibu [ya Afya na Huduma za Kibinadamu] kwamba kuna dharura ya afya ya umma, au uwezekano mkubwa wa dharura ya afya ya umma, ambayo huathiri, au ina uwezekano mkubwa wa kuathiri, usalama wa taifa au afya na usalama wa Umoja Nchi raia wanaoishi nje ya nchi, na hiyo inahusisha wakala wa kibayolojia, kemikali, radiolojia, au nyuklia, au ugonjwa au hali ambayo inaweza kuhusishwa na wakala au mawakala; au
- utambulisho wa tishio la nyenzo kwa mujibu wa kifungu cha 319F–2 cha Sheria ya Huduma ya Afya ya Umma [42 USC 247d–6b] inatosha kuathiri usalama wa taifa au afya na usalama wa Umoja Nchi wananchi wanaoishi nje ya nchi.
EUA Hatua ya 2. Kukidhi Vigezo vya Kisheria
Mara baada ya mmoja wa makatibu kutangaza kuwa kuna dharura inayoidhinisha EUA, kuna "vigezo" vingine vinne ambavyo vinapaswa kufikiwa ili FDA itoe EUA. Hivi ndivyo FDA inaelezea mahitaji haya:
- Ugonjwa au Hali mbaya sana au ya Kuhatarisha Maisha
Ili FDA itoe EUA, wakala wa CBRN anayerejelewa katika tamko la EUA la Katibu wa HHS lazima awe na uwezo wa kusababisha ugonjwa au hali hatari kwa maisha.
- Ushahidi wa Ufanisi
Bidhaa za kimatibabu zinazoweza kuzingatiwa kwa ajili ya EUA ni zile ambazo “zinaweza kuwa na ufanisi” kuzuia, kutambua, au kutibu magonjwa au magonjwa hatari au yanayohatarisha maisha ambayo yanaweza kusababishwa na wakala wa CBRN aliyetambuliwa katika tamko la Katibu wa HHS kuhusu. dharura au tishio la dharura chini ya kifungu cha 564(b).
Kiwango cha "huenda kikafaa" kwa EUAs kinatoa kiwango cha chini cha ushahidi kuliko kiwango cha "ufaafu" ambacho FDA hutumia kuidhinisha bidhaa. FDA inakusudia kutathmini ufanisi unaowezekana wa bidhaa ya EUA inayowezekana kwa msingi wa kesi baada ya kesi kwa kutumia uchanganuzi wa faida ya hatari, kama ilivyoelezwa hapa chini.
[BOLDUSO UMEONGEZWA]
- Uchambuzi wa Faida-Hatari
Bidhaa inaweza kuchukuliwa kwa ajili ya EUA ikiwa Kamishna ataamua kuwa manufaa yanayojulikana na yanayoweza kutokea ya bidhaa, inapotumiwa kutambua, kuzuia, au kutibu ugonjwa au hali iliyotambuliwa, inapita hatari zinazojulikana na zinazowezekana za bidhaa.
Katika kubainisha iwapo manufaa yanayojulikana na yanayowezekana ya bidhaa yanapita hatari zinazojulikana na zinazoweza kutokea, FDA inakusudia kuangalia kwa jumla ya ushahidi wa kisayansi kufanya uamuzi wa jumla wa faida ya hatari. Ushahidi kama huo, ambao inaweza kutokea kutoka vyanzo mbalimbali, inaweza kuhusisha (lakini sio tu): matokeo ya majaribio ya kliniki ya ndani na nje, data ya ufanisi wa vivo kutoka kwa mifano ya wanyama, na data ya vitro, inapatikana kwa kuzingatia FDA. FDA pia itatathmini ubora na wingi wa ushahidi unaopatikana, kutokana na hali ya sasa ya ujuzi wa kisayansi.
[BOLDUSO UMEONGEZWA]
- Hakuna Njia Mbadala
Ili FDA itoe EUA, ni lazima pasiwe na mbadala wa kutosha, ulioidhinishwa na unaopatikana kwa bidhaa iliyoteuliwa kwa ajili ya kuchunguza, kuzuia, au kutibu ugonjwa au hali hiyo. Bidhaa mbadala inayoweza kuzingatiwa inaweza kuchukuliwa kuwa "haipatikani" ikiwa hakuna vifaa vya kutosha vya njia mbadala iliyoidhinishwa ili kukidhi kikamilifu hitaji la dharura.
EUA Hatua ya 3. Kuweka Masharti Yanayohitajika
Pindi tu tunapokuwa na tamko la dharura mahususi la EUA, na mara tu FDA inapoamua kuwa bidhaa hiyo inaweza kuwa na ufanisi na kwamba ushahidi wowote unaopatikana unaonyesha kuwa manufaa yake yanazidi hatari zake, kuna safu moja zaidi ya udhibiti unaohusiana.
Hivi ndivyo jinsi a Ripoti ya 2018 ya Huduma ya Utafiti ya Bunge kuhusu EUA inaelezea hivi:
FFDCA §564 inaelekeza FDA kuweka masharti fulani yanayohitajika katika EUA na inaruhusu masharti ya ziada ya hiari inapofaa. Masharti yanayohitajika yanatofautiana kulingana na iwapo EUA ni ya bidhaa ambayo haijaidhinishwa au kwa matumizi yasiyoidhinishwa ya bidhaa iliyoidhinishwa. Kwa bidhaa isiyoidhinishwa, masharti ya matumizi lazima:
(1) kuhakikisha kwamba wataalamu wa afya wanaosimamia bidhaa wanapokea taarifa zinazohitajika;
(2) kuhakikisha kwamba watu binafsi ambao bidhaa inasimamiwa wanapokea taarifa zinazohitajika;
(3) kutoa ufuatiliaji na taarifa ya matukio mabaya yanayohusiana na bidhaa; na
(4) kutoa kwa ajili ya kuhifadhi na kuripoti na mtengenezaji.
Hitimisho
Kama ilivyobainishwa katika makala haya, FDA/CDC inatambua wazi kwamba mchakato wa kutoa Uidhinishaji wa Matumizi ya Dharura (EUA) hauwezekani kutoa taarifa yoyote kuhusu ufanisi au usalama wa bidhaa. Tunapoangalia barua ya sheria inayoongoza EUA, tunaona kwamba hii ni, kwa kweli, tathmini sahihi.
Sheria ya EUA haiweki viwango vyovyote vya kisheria au vya udhibiti ambavyo vinaweza kuamua ikiwa bidhaa ni salama au inafaa. Viwango pekee ni kama FDA inaamini kuwa bidhaa hiyo inaweza kuwa bora na kwamba faida zake zinazojulikana ni kubwa kuliko madhara yake yanayojulikana. Ikiwa hakuna madhara yanayojulikana au manufaa yanayojulikana, kwa sababu bidhaa haijawahi kupitia mchakato wa kuidhinisha dawa, FDA inaweza kutumia taarifa au viwango vyovyote itakavyochagua kufanya uamuzi huo.
Kutokana na haya yote, kampuni ambayo bidhaa yake ni mwaniaji wa EUA inaweza kujaribu kuonyesha usalama na/au ufanisi wa bidhaa kupitia njia zozote inazochagua. Kuwepo kwa jaribio kama hilo (iwe jaribio la kimatibabu au utaratibu mwingine wa kukusanya data), na jinsi jaribio hilo linavyofanywa, yote ni juu ya kampuni. Hakuna chochote katika sheria ya EUA kinachotumika kwa jinsi kampuni inavyobuni, kuendesha au kuchanganua masomo yoyote au mbinu nyinginezo za kukusanya data inazochagua kufuata.
Inatumika kwa bidhaa za Covid hii inamaanisha:
- Hakuna data ya usalama au ufanisi kutoka kwa majaribio ya kimatibabu iliyohitajika ili bidhaa za Covid zipokee EUA.
- Majaribio yoyote ya kimatibabu yaliyorejelewa katika mchakato wa EUA yalifanywa bila viwango vya udhibiti vinavyotumika kisheria.
- Tunapogundua kuwa bidhaa hizi hazina ufanisi au usalama, hiyo haishangazi. Ni matokeo ya uwezekano mkubwa wa mchakato.
- Hakuna data kutoka kwa mchakato wa EUA ambayo inaweza msingi wa maamuzi yasiyo ya EUA kuhusu usalama au ufanisi wa bidhaa. Kwa hivyo matumizi yoyote yasiyo ya EUA ya bidhaa yatahitaji kupitia mchakato wa idhini ya kisheria kwa bidhaa za matibabu za kawaida tangu mwanzo.
Zaidi kuhusu mchakato wa kuidhinisha chanjo za Covid hapa.
Imechapishwa tena kutoka kwa mwandishi Kijani kidogo
Imechapishwa chini ya a Ushirikiano wa ubunifu wa Commons 4.0 Leseni ya Kimataifa
Kwa machapisho mapya, tafadhali rudisha kiungo cha kisheria hadi cha asili Taasisi ya Brownstone Makala na Mwandishi.









